Аррениус С.-А. 
Бертолле К.-Л. 
Брёнстед Й. 
Бунзен Р. 
Бутлеров А. 
Вант-Гофф Я.-Х. 
Вёлер Ф. 
Вернер А. 
Воскресенский А.
Арре́ниус, Сва́нте А́вгуст
(швед. Svante August Arrhenius)
Родился 19 февраля 1859 года — умер 2 октября 1927 года
Шведский физик и химик родился в замке Вик в коммуне Уппсала. В 1878 году получил степень бакалавра естественных наук в Уппсальском университете, а с 1881 года начал изучать проводимость электролитов в Физическом институте Королевской шведской академии.
При проведении исследований Аррениус обратил внимание, что проводимость растворов при разбавлении увеличивается. Благодаря этому открытию была сформулирована теория об электролитической диссоциации[1]. В этой теории он предположил распад (диссоциацию) электролитов в растворах в отсутствие каких-либо внешних сил.
В 1884 году, используя теорию электролитической диссоциации, учёный предложил кислотой считать вещество, образующее в растворе ионы водорода, а основанием — вещество, дающее в растворе гидроксид-ионы.
Аррениус разработал теорию гидролиза солей, установил экзотермический характер большинства процессов диссоциации электролитов и зависимость скорости и полноты протекания этих процессов от температуры.
Изучая химическую кинетику, смог объяснить температурную зависимость скорости реакций, ввёл понятие энергии активации Ea. Аррениус вывел уравнение зависимости константы скорости реакции от фактора частоты столкновения молекул A, температуры и Ea (уравнение Аррениуса):
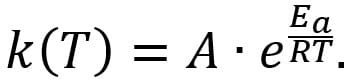
1 Электролитическая диссоциация — это процесс распада молекул на ионы при растворении или плавлении.

Бертолле́, Клод-Луи
(фр. Claude Louis Berthollet)
Родился 9 декабря 1748 года — умер 6 ноября 1822 года
Французский химик родился во Франции в местечке Савойя. Клод Луи Бертолле обучался в Туринском университете. В 1770 году получил степень доктора медицины.
В 1770–1783 годах работал практикующим врачом и аптекарем, занимался изучением естественных наук, изучал неорганическую химию, химию растворов и сплавов.
В 1785 году установил состав аммиака.
В 1786 году определил состав болотного газа и синильной кислоты, открыл соли хлорноватистой и хлорноватой кислот, хлорат калия («бертолетова соль»).
В 1787 году Бертолле описал метод окислительно-восстановительного титрования.
Окислительно-восстановительное титрование — это метод определения окислителей или восстановителей, который основан на использовании окислительно-восстановительных реакций (ОВР), протекающих между определяемым веществом и титрантом[1]. Окислителем является вещество, которое принимает электроны.
В 1788 году установил состав сероводорода и открыл нитрид серебра («бертолетово гремучее серебро»). Для отбеливания бумаги и тканей применил хлор. На основании наблюдений за процессами выпадения осадков из растворов Бертолле пришёл к выводу о зависимости направления реакций и состава образующихся соединений от массы реагентов и условий протекания реакций.
В память о Бертолле были названы бертоллидами вещества переменного состава, существование которых открыл в начале XX века Н. С. Курнаков.
1 Титрант — вещество-реагент, для которого точно известна концентрация. Титрант добавляют к раствору, чтобы провести количественный анализ веществ, которые содержатся в растворе, или их элементов.

Брёнстед, Йога́ннес Николаус
(дат. Johannes Nicolaus Brønsted)
Родился 22 февраля 1879 года — умер 17 декабря 1947 года
Датский физик и химик родился в Варде на западе Дании. В 1902 году Йоханнес окончил Копенгагенский университет. В 1905 году начал работать в этом университете, а в 1908 году стал профессором.
Йоханнес Брёнстед исследовал химическую кинетику, катализ и термодинамику растворов[1], изучал каталитические реакции, кинетические свойства ионов в растворах. В 1923 году он предложил теорию кислот и оснований, которая стала основой для развития современной теории кислот и оснований и помогла объяснить многие химические процессы.
Брёнстед установил количественное соотношение между силой кислот и оснований и их каталитической активностью (уравнение Бренстеда — уравнение, количественно описывающее зависимость скорости катализируемых кислотами или основаниями реакций от природы катализатора).
Для кислотного катализа уравнение выражается в виде
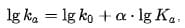
где ka — каталитическая константа скорости реакции; Ka — константа кислотности кислоты, выступающей в качестве катализатора; k0 — константа скорости некатализируемой реакции; α — константа, характеризующая реакционную серию и отражающая чувствительность скорости реакции к смене катализатора.
В общем виде уравнение записывается в виде
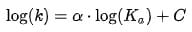
как линейная зависимость константы скорости реакции от логарифма константы ионизации Ka кислот одной серии (например, замещённые фенолы, карбоновые кислоты и другие).
1 Раствор — однородная система, в состав которой входят молекулы (атомы, ионы) двух или более типов, причём доля частиц каждого типа может непрерывно меняться в определённых пределах.

Бу́нзен, Ро́берт Вильге́льм
(нем. Robert Wilhelm Bunsen)
Родился 31 марта 1811 года — умер 16 августа 1899 года
Немецкий химик-экспериментатор родился в Гёттингене. В 1828 году поступил в университет своего родного города, где изучал физику, химию и геологию. В 1833 году успешно защитил диссертацию по химии в Геттингенском университете.
Первые работы Бунзена касаются различных вопросов неорганической химии, но вскоре он стал исследовать арсеноорганические соединения. Результатом стало получение арсендиметила.
Работы с газообразными веществами привели Бунзена к открытию новых методов, совокупность которых создала нынешний анализ газов.
В 1860 году совместно с Густавом Кирхгофом был открыт спектральный анализ, который позволил открыть немало новых редких элементов: рубидий, цезий.
Бунзен занимался исследованием двойных цианистых солей, определением атомного веса индия, анализом пороховых и газов доменных печей, систематическим изложением реакций окрашивания в пламени бунзеновской горелки.
Очень важным открытием Бунзена было открытие противоядия (водной окиси железа) при отравлении мышьяком (мышьяковистой кислотой). Бунзен проводил исследования относительных удельных весов, влияния давления на температуру затвердевания расплавленных веществ; исследования о зависимости растворимости газов от давления, явлений горения газов и о сгущении сухой угольной кислоты на поверхности стекла, калориметрические исследования и многие другие. Им были изобретены многие приборы, которые носят его имя. Например, колба Бунзена, бунзеновская горелка, бунзеновский водяной насос и регулятор, бунзеновская батарея, бунзеновский абсорбциометр (рис.1).




Бу́тлеров, Алекса́ндр Миха́йлович
Родился 3 сентября 1828 года — умер 5 августа 1886 года
Русский химик родился в городе Чистополь Казанской губернии. В 1844 году поступил в Казанский университет, где получил подготовку в области ботаники и зоологии.
В 1851 году Бутлеров защитил магистерскую диссертацию по химии «Об окислении органических соединений», а в 1854 году в Московском университете — докторскую диссертацию «Об эфирных маслах» и получил степень доктора химии.
Первое выступление А. М. Бутлерова по теоретическим вопросам органической химии состоялось 17 февраля 1858 года. В нём говорилось, что радикалами[1] следует считать не только органические группы, но и OH, NH2, то есть характерные для различных классов органических веществ сочетания атомов. Эти сочетания атомов впоследствии получили название функциональных групп. Бутлеров впервые объяснил явление изомерии тем, что изомеры — это соединения, обладающие одинаковым элементарным составом, но различным химическим строением.
Основными положениями теории Бутлерова являются:
- химические свойства органических соединений определяются их структурой;
- различные атомы и группы атомов в органической молекуле оказывают взаимное влияние друг на друга;
- химическая структура молекулы может быть представлена только одной формулой, которая выражает все химические свойства данного вещества.
1 Радикал (в химии) — это атом или молекула, имеющая один или несколько неспаренных электронов.

Вант-Гофф, Я́коб-Хе́ндрик
(нидерл. Jacobus Henricus (Henry) van ’t Hoff)
Родился 30 августа 1852 года — умер 1 марта 1911 года
Нидерландский химик родился в Роттердаме. Является одним из основателей стереохимии[1] и химической кинетики. С восьми лет Якоб обучался в частной школе, где большое внимание уделялось изучению естественных наук и математики. В 1869 году поступил в Политехническую школу, чтобы получить диплом химика-технолога.
В октябре 1871 года Вант-Гофф становится студентом Лейденского университета, затем переводится в Боннский университет, чтобы лучше изучать химию. В Боннском университете в то время профессором химии был Фридрих Август Кекуле.
22 декабря 1874 года Вант-Гофф защищает докторскую диссертацию, посвящённую синтезу цианоуксусной и малоновой кислот.
В 1881 году была издана книга «Воззрения по органической химии», в которой учёный попытался установить взаимную связь между строением веществ и их физическими и химическими свойствами. При работе над этой книгой он пришёл к проблеме химического сродства, к признанию значения химической термодинамики и к проблемам химического равновесия и скорости химических реакций.
В 1884 году выходит наиболее известная книга Вант-Гоффа «Очерки по химической динамике». Появление этой книги ознаменовало рождение физической химии. Вант-Гофф впервые широко использовал принципы термодинамики и математические методы для анализа и объяснения наблюдаемых химических процессов.
В 1885 году учёный представил теоретическую работу «Химическое равновесие в системах газов и разбавленных растворов». После опубликования работ по химической динамике и равновесию имя Вант-Гоффа получило широкую известность в учёном мире.
В 1901 году Вант-Гофф стал первым лауреатом Нобелевской премии по химии.
Правило Вант-Гоффа — правило, позволяющее оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0°C до 100°C). Оно звучит следующим образом: при повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два—четыре раза.
1 Стереохимия (структурная химия) — раздел химии о пространственном строении молекул и влиянии его на химические свойства и на направление и скорость реакций.

Вёлер, Фри́дрих
(нем. Friedrich Wöhler)
Родился 31 июля 1800 года — умер 23 сентября 1882 года
Немецкий химик родился в городе Эшерсхейм. По образованию Вёлер был врачом. С 1820 года изучал медицину в Марбургском университете, а в 1823 получил учёную степень по медицине в Гейдельбергском университете.
Он заинтересовался химией и в 1823–1824 годах работал в лаборатории под руководством известного химика Йёнса Якоба Берцелиуса. При приготовлении цианово-кислого аммония NH4CNO Вёлером было получено бесцветное кристаллическое вещество, которое не давало ни одной из реакций на аммоний и циановую кислоту. В 1828 году было установлено, что оно по составу и свойствам тождественно с мочевиной. Вёлер впервые синтезировал из неорганического вещества органическое соединение.
В 1832 году Фридрих Вёлер и Юстус Либих показали, что радикал бензоил C7H5O без изменений переходит из одного соединения в другое, чем сильно укрепили теорию радикалов. Эта реакция получила название бензоиновой конденсации.
В 1838 году Вёлер (совместно с Юстусом фон Либихом) исследовал мочевую кислоту и её производные, в 1840 году был получен диэтилтеллур, а в 1844 году — гидрохинон и исследованы алкалоиды опия.
Вёлер проводил исследования в области неорганической химии: в 1827 году — получение алюминия нагреванием хлористого алюминия с калием, а в 1828 — подобным путём были получены бериллий и иттрий, в 1856–1858 годах были проведены исследования и получен кремний и его соединений с водородом и с хлором, в 1857–1858 годах — получены нитриды кремния и титана, в 1862 — получен карбид кальция и ацетилен — результат действия воды на карбид кальция. Он открыл щавелевую кислоту.
Вёлер создал большую научную школу и написал учебные руководства, получившие широкое распространение. Его работы внесли большой вклад в изучение свойств и способов получения кальция, титана, ванадия, ниобия.

В́ернер, А́льфред
(нем. Alfred Werner)
Родился 12 декабря 1866 году — умер 15 ноября 1919 году
Швейцарский химик родился в городе Мюлуз. В 1878 году поступил в Техническое училище, где увлёкся химией. Он стал проводить химические опыты дома. Однажды случился взрыв, разрушивший часть дома, в котором он жил. Чтобы покупать реактивы и химическую посуду, Альфреду Вернеру приходилось работать.
В октябре 1885 года он был призван в армию на один год. После прохождения воинской службы Вернер продолжил обучение в Технологическом институте в Цюрихе. На четвёртом курсе обучения выбрал в качестве специальности органическую химию. В начале 1889 года он закончил дипломную работу, в которой описал изобретённые им методики получения некоторых органических и неорганических соединений, в том числе сероуглерода, фенилгидразина, флуоресцеина.
После окончания института Вернер остался в лаборатории Г. Лунге в качестве внештатного сотрудника и начал работу над докторской диссертацией под руководством Артура Ганча. Защита диссертации состоялась осенью 1890 года. Вернеру была присуждена учёная степень доктора философии.
В конце 1891 года Вернер закончил работу под названием «К теории сродства и валентности». В Париже в 1891–1892 годах Вернер провёл первое исследование по неорганической химии — «Об основном нитрате кальция» с использованием сложных термохимических методов, а также прочёл и опубликовал доклад «Стереохимия азота».
Первая статья Вернера по координационной теории была написана в декабре 1892 года, а в период с 1893 по 1900 год в ведущих европейских химических журналах было опубликовано около 40 статей под общим названием «О строении неорганических соединений».
В 1913 году Вернер стал лауреатом Нобелевской премии по химии.

Воскресе́нский, Алекса́ндр Абра́мович
Родился 25 ноября 1809 года — умер 21 января 1880 года
Русский химик родился в городе Торжок Тверской губернии. Был сыном священника, обучался в семинарии. В 1832 году поступил в Педагогический институт, который окончил с золотой медалью. После окончания института был направлен на стажировку в европейские университеты для подготовки профессорской деятельности.
За границей Воскресенский изучал химические методы исследования у многих известных учёных в Берлине, Гисене. В 1838 году были опубликованы первые статьи учёного: «Действие серного ангидрида на маслородный газ», «Состав хинной кислоты» и «Элементарный состав нафталина». В 1839 году получил степень доктора философии (доктора естествознания) за сочинение о хинной кислоте.
Воскресенским был открыт теобромин[1] и установлен его состав (рис.1). Были исследованы образцы донецких каменных углей и установлено, что их состав проходит по требованиям техники, и они ни в чём не уступают иностранным образцам.
Воскресенский старался сделать популярным применение и производство из отечественного сырья минеральных удобрений в России.
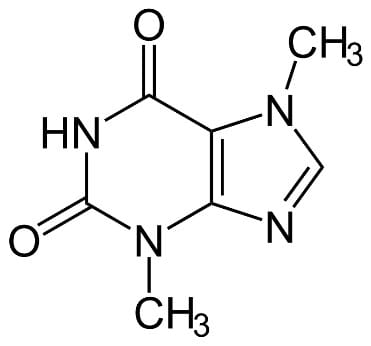
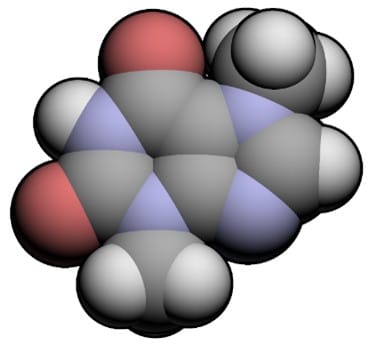
1 Теобромин — алкалоид, который содержится в бобах какао.